侾丏偼偠傔偵
壔妛偺妛廗偵偍偄偰丆帣摱惗搆払傪嬃扱偝偣傞尰徾偲偟偰丆怓偺曄壔傗敋敪斀墳偲暲傫偱丆寢徎偺愅弌偍傛傃惉挿偑偁偘傜傟傞偱偁傠偆丏偦偙偱丆懡偔偺巕嫙丒惗搆払偑斾妑揑娙扨偵偒傟偄側寢徎偑摼傗偡偄僇儕儈儑僂僶儞偐傜巒傔偰丆庬乆偺暔幙偺寢徎嶌傝偵挧愴偡傞丏偦偺偆偪丆恎嬤側暔幙偱偁傞怘墫偵偮偄偰傕丆摟柧偱戝偒側寢徎傪嶌傝偨偔側傞丏
丂偟偐偟丆怘墫偼師偺傛偆側偄偔偮偐偺惈幙傪帩偭偰偄傞偨傔丆悈梟塼偐傜戝偒偔偰偒傟偄側寢徎傪嶌傞偙偲偑擄偟偄丏戞堦偼丆怘墫偺壏搙曄壔偵傛傞梟夝搙偺曄壔偑彫偝偄偨傔丆椻媝朄偵傛偭偰抁帪娫偵戝偒側寢徎傪摼傞偙偲偑擄偟偄丏戞擇偼丆杮棃悈梟塼偐傜偺寢徎偺愅弌偼朞榓梟塼傛傝傕傢偢偐偵夁朞榓偵側偭偨忬懺偱巒傑傞偑丆偦偺夁朞榓椞堟偑怘墫悈偱偼嫹偔偰晄埨掕側偨傔丆偪傚偭偲偟偨怳摦傗徴寕偍傛傃晄弮暔偺崿擖偵傛傝丆庬寢徎傊偺惉挿偩偗偱側偔廃曈偵傕旝寢徎偑愅弌偟傗偡偔側傞丏偝傜偵怘墫偼寢徎悈傪帩偨側偄寢徎峔憿偱偁傞偨傔丆偁傑傝寢徎壔懍搙偑懍偡偓傞偲丆悈梟塼傪寢徎撪偵庢傝崬傫偱丆敀戺偟傗偡偔側傞丏
丂偙傟傜偺栤戣揰傪夝徚偡傞偨傔偵丆寢徎偺宍懺偍傛傃摟柧搙偵塭嬁傪梌偊傞旝検偺堎庬僀僆儞傪梟塼拞偵嫟懚偝偣傞曽朄偑抦傜傟偰偄傞1),2)丏椺偊偽丆Mn2+,Pb2+,Cd2+,Hg2+摍偑偁傞偲丆摟柧側寢徎偵側傝傗偡偔丆Ca2+,Mg2+摍偱偼晄摟柧偵側傝傗偡偄丏慜幰偵偮偄偰偼攠徎嶌梡偲偟偰抦傜傟丆摿庩墫偺惢憿摍偵傕棙梡偝傟偰偄傞丏廬棃偺尋媶偱傕丆攠徎岠壥偵偮偄偰偳偺掱搙偺擹搙偺攠徎僀僆儞偑懚嵼偡傞偲岠壥揑偱偁傞偐挷傋傜傟偰偒偨丏
恾侾丏奺庬宍忬怘墫

丂変乆傕偡偱偵丆怘墫悈偵旝検偺墧僀僆儞偑懚嵼偡傞偲丆弨埨掕側夁朞榓椞堟偺奼戝偍傛傃椪奅惉挿懍搙乮偦傟埲忋偺徎弌懍搙偩偲寢徎偑晄摟柧乷奫徎乸偵惉挿偡傞乯偺尷奅偺奼戝偵傛傝丆摟柧側怘墫寢徎偑摼傜傟傗偡偔側傞偙偲傪曬崘偟偨3)丏崱夞偼偝傜偵敪揥偝偣偰丆寢徎壔偟偨怘墫偵偳偺掱搙墧僀僆儞偑庢傝崬傑傟傞偺偐傪挷傋偨丏傑偨丆幚嵺偵怘墫偺寢徎傪愅弌偝偣偨応崌偺庬乆偺宍懺偵偮偄偰挷傋丆偦偺嵟揔忦審偐傜戝偒側怘墫傪摼傞曽朄偍傛傃丆寢徎偺傊偒奐偺惈幙傗戝偒側摟柧怘墫傪棙梡偟偨岝妛嵽椏傗傾儃僈僪儘悢偺應掕嵽椏偺壜擻惈傕専摙偟偨丏
俀丏愅弌偟偨怘墫拞偵娷傑傟傞墧偺検
墧僀僆儞偺旝検暘愅偼丆堦斒偵斾怓朄偑梡偄傜傟丆暋嶨側慜張棟偲媧岝岝搙寁偺傛偆側婡婍偑昁梫偵側傞丏偙偙偱偼丆惛搙偼彮偟棊偪傞偑偳偙偺妛峑偱傕娙扨偵峴偊傞擇庬偺揌掕朄偵傛偭偰挷傋偨丏
乵應掕尨棟乶
丂堦偮偼墧僀僆儞偲僋儘儉巁僀僆儞偑斀墳偟偰偱偒傞僋儘儉巁墧偑擄梟惈偱偁傞偙偲傪棙梡偟偨傕偺偱偁傞丏僋儘儉巁墧偺梟夝搙愊偼
Ksp=乵Pb2+乶乵CrO42-乶= 2.5亊10-8乵moldm-3乶2偲旕忢偵彫偝偔丆旝検偺墧僀僆儞傪娷傓梟塼偵丆堦掕婓庍偟偨K2CrO4梟塼傪揌壓偟偰捑揳偑惗偠偨強傪廔揰偲偟偨丏
懠曽偼墧僀僆儞偑EDTA乮僄僠儗儞僕傾儈儞巐恷巁乯偲埨掕側墿怓嶖懱傪宍惉偡傞丏墧僀僆儞傪娷傓梟塼
嘆僩儗儈乕乮昞柺乯丂丂嘇惓曽宍乮掙柺乯丂嘊奫徎乮晄摟柧乯 丂丂嘋惓榋柺懱乮摟柧乯丂丂嘍庽巬忬徎
偵嬥懏巜帵栻偺僉僔儗僲乕儖僆儗儞僕乮XO乯傪壛偊丆EDTA梟塼傪巊偭偰揌掕偡傞丏帋椏偲偟偨怘墫偼丆梟塼拞偺墧僀僆儞偺擹搙傪偄傠偄傠曄偊偰摼傜傟偨傕偺傪棙梡偟偨丏
幚尡侾 僋儘儉巁墧偺梟夝搙愊偵傛傞墧偺掕検
墧僀僆儞傪娷傓梟塼偐傜愅弌偟偨怘墫 1.00g 傪偼偐傝偲傝丆10.0噋3偺悈偵梟夝偡傞丏偙傟傪50噋3嶰妏僼儔僗僐偵擖傟丆價儏儗僢僩偐傜3.0亊10-4mol丒dm-3
K2CrO4梟塼傪揌壓偟丆捑揳偑惗偠偨偲偙傠傪廔揰偲偟丆墧偺検傪寁嶼偡傞丏
幚尡俀 EDTA偵傛傞墧偺掕検
幚尡侾偲摨偠傛偆偵怘墫1.00g傪悈10噋3偵梟偐偡丏偙偺梟塼傪pH=4偱僉僔儗僲亅儖僆儗儞僕乮XO乯傪壛偊丆1.0亊10-2mol丒dm-3偺EDTA梟塼偱揌掕偡傞丏梟塼偑烌怓偐傜墿怓偵曄傢偭偨偲偙傠傪廔揰偲偟丆墧偺検傪寁嶼偡傞丏
寢壥偲峫嶡
朞榓怘墫悈拞偺墧僀僆儞偺擹搙偑懳mol斾偱,10-4埲忋偱偁傞偲丆愅弌偡傞怘墫偺寢徎傪摟柧偵偡傞岠壥偑偁偭偨丏偨偩偟丆10-4慜屻偱偁傞偲寢徎暯柺偑墯撌偺偁傞寢徎偵側傝傗偡偄丏10-3掱搙偵側傞偲丆昞柺偺峳傟曽傕彮側偔摟柧搙傕傛偄丏10-5慜屻偵側傞偲彫寢徎偑愅弌偟傗偡偔丆摟柧搙傕埆偔側傞丏

偨偩偟丄嘆乣嘒偼朞榓怘墫悈拞偵埲壓偺擹搙偺梟塼傪巊梡偟偨丏 丂懳mol斾(Pb/Na)
嘆 恷巁墧丂1.0亊10-3moldm-3 2.2亊10-4
嘇 恷巁墧 3.0亊10-3moldm-3 6.6亊10-4
嘊 恷巁墧 6.0亊10-3moldm-3 1.3亊10-3
嘋 恷巁墧 1.0亊10-2moldm-3 2.2亊10-3
嘍 恷巁墧 3.0亊10-2moldm-3 6.7亊10-3
嘐 墧斅丂 12.0g傪巊梡
嘑 墧僈儔僗 5.65g乮栐栚偺奐偒1.0乣2.0mm乯傪巊梡
嘒 墧側偟
丂Pb/Na mol斾10-3乣10-4掱搙偱愅弌偟偨怘墫1.00g拞偵娷傑傟傞墧僀僆儞傪揌掕偱挷傋偨寢壥偼丆僋儘儉巁僇儕僂儉揌掕朄偱偼昞侾偺傛偆偵側偭偨丏
丂EDTA揌掕偺寢壥偼昞俀偵帵偡偑丆嬌偔旝検偺墧偱偁傞偺偱丆僶儔僣僉偑偁傞偑慡懱偲偟偰偼幚尡侾偲摨偠寢壥偵側偭偨丏偙偺寢壥傪傒傞偲丆奺庬擹搙偺墧僀僆儞傗墧斅丆墧僈儔僗偺偄偢傟偺応崌傕傎傏堦掕偺墧偑娷桳偝傟偰偄傞偙偲偑傢偐偭偨丏愅弌偟偨怘墫
1.00g 拞偵栺1mg 偺墧偑娷傑傟偰偄傞丏偦偟偰丆Pb/Na偺mol斾傪傒傞偲丆栺2乣3亊10-4掱搙偲側偭偰偍傝丆Na棻巕4乣5亊103屄偵懳偟偰Pb棻巕偑1屄偺妱崌偲側偭偰偄傞丏
俁丏愅弌偡傞怘墫寢徎偺庬乆偺宍懺
捠忢朞榓怘墫悈傛傝寢徎壔偝偣傞偲偒丆塼拞偱惉挿偝偣傞偲惓榋柺懱偵側傝丆梟塼偺昞柺忋偱惉挿偡傞偲丆拞嬻偺巐妏悕忬偺僩儗儈乕偵側傞丏寢徎壔懍搙偑懍偡偓傞偲惓榋柺懱傕奫徎忬偵側傞丏傑偨丆梕婍掙柺偱惉挿偡傞偲暯斅惓曽宍偵側傞丏寢徎壔懍搙傕丆偁傞椪奅惉挿懍搙埲忋偵側傞偲丆晄摟柧偵側傞乮傎偲傫偳偺応崌梟塼傪庢傝崬傓偐奿巕寚娮偑偱偒傞乯丏摿偵丆寢徎壔偺弶婜抜奒偱偼丆扨埵帪娫摉偨傝偺愅弌検偼堦掕偱傕丆揰偺傛偆側庬寢徎偐傜偺堦幉曽岦偺惉挿懍搙偼丆憡摉戝偒偔側傞偺偱丆傎偲傫偳偺応崌拞怱晅嬤偼晄摟柧偵側傞丏
恾俀丏怘墫寢徎偺庬乆偺宍懺
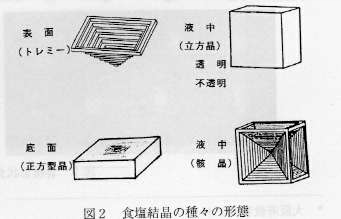
丂Pb2+偺傛偆側攠徎嶌梡傪傕偮僀僆儞偑崿擖偟偰偔傞偲丆椪奅惉挿懍搙偺尷奅抣傕戝偒偔側傝丆摟柧側寢徎偑愅弌偟傗偡偔側傞乮儌儖斾1:10000埵偐傜岠壥偑偱偰偔傞乯丏墧僀僆儞偺懚嵼壓偱丆怘墫傪戝偒偔惉挿偝偣傞偲丆榋柺懱偺柺埲奜偵丆惓敧柺懱偺柺乷乮1,1,1乯柺乸偑尰傟偰偔傞丏偙傟偼墧僀僆儞偑擹偄傎偳丆傑偨丆惉挿懍搙偑抶偄掱岠壥偑戝偒偄丏
丂乵恓忬寢徎乶
庬寢徎傪摼傛偆偲偟偰丆戝偒側梕婍偱懡偔偺怘墫偺寢徎傪愅弌偝偣傞偲偒丆偲偒偳偒恓忬寢徎偑娤嶡偝傟傞丏堦斒偵丆Ca2+傗Mg2+偺擹岤梟塼偑嫟懚偟偰偄偨傝丆懡岴幙梕婍乮慺從偒丒僐儘僕僆儞枌摍乯偐傜愅弌偡傞偲偒偵弌傗偡偄偲偄傢傟傞偑丆妋幚偵嵞尰偡傞偲偙傠傑偱帄偭偰偄側偄丏
丂乵庽巬忬寢徎乶
庽巬忬寢徎偲偄偊偽丆帺慠奅傪傛偔尒搉偡偲懡悢懚嵼偟偰偄傞丏椺偊偽丆愥偺寢徎偱偁傞偲偐丆娾愇拞偺峼暔偺寢徎側偳偑偁傞丏壔妛椞堟偺幚尡偱偼丆嬥懏僀僆儞偺僀僆儞壔孹岦偺堘偄傪抦傞丆僀僆儞岎姺斀墳偵傛傞嬥懏庽偺愅弌側偳偑偁傞丏寢徎偺尋媶偲偄偆偲丆偒傟偄側扨寢徎傪挷傋傞偺偑忢朄偱偁傞偑丆嵟嬤暋嶨偝偺拞偵偁傞婯懃惈傪撉傒庢傠偆偲偡傞僇僆僗傗僼儔僋僞儖偺壢妛偑帺慠傪棟夝偡傞堦庤抜偲偟偰拲栚偝傟偰偄傞丏
丂怘墫偺庽巬忬寢徎偼丆埲壓偺傛偆偵偟偰偱偒傞丏朞榓偵嬤偄怘墫悈偵丆僿僉僒僔傾僲揝乮嘦乯巁僇儕僂儉0.2亾慜屻偺梟塼傪僈儔僗斅忋偵揌壓偟丆晽姡偡傞偲怘墫偺庽巬忬寢徎偑愅弌偡傞丏
恾俁丏怘墫偺庽巬忬寢徎偺嶌傝曽
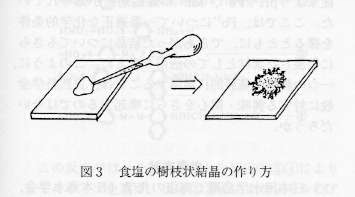
丂偨偩偺朞榓怘墫悈偩偗偱傕媫懍偵姡憞偡傞偲庽巬忬傜偟偒傕偺偑偱偒傞偑丆偼偭偒傝庽巬忬偵偼尒偊側偄丏揌壓偟偨椞堟偑敿暘埲忋姡憞偟偼偠傔傞崰偐傜媫偵椞堟偺奜懁偵岦偐偭偰庽巬忬寢徎偑惉挿偡傞丏偙偺寢徎偼儈僋儘儗儀儖偱偺彫偝側寢徎偑屳偄偵嫮偔偮側偑傜偢偵丆柸偺傛偆偵廮傜偐偝傕帩偭偨旝寢徎偺廤傑傝偵側偭偰偄傞丏
係丏摟柧偱戝偒側怘墫偺寢徎偺嶌傝曽偲偦偺嫵嵽壔
乵忲敪朄偵傛傞摟柧怘墫偺嶌傝曽乶
朞榓怘墫悈1dm3偵墧僀僆儞10-3mol乮恷巁墧姺嶼偵偟偰0.38g乯傪梟偐偟偨梟塼傑偨偼朞榓怘墫悈偵墧斅傪怹偟偨梟塼偐傜帺慠忲敪朄偵傛偭偰丆摟柧偱戝偒側怘墫偺寢徎偑摼傜傟傞丏梕婍偼掙偑暯傜偱丆曎摉敔偺傛偆側僶僢僩忬偺傕偺偑堦搙偵偨偔偝傫偺寢徎偑摼傜傟偰曋棙偱偁傞丏偨偩偟丆忋柺偑僆乕僾儞偺傑傑偱偁傞偲丆忲敪懍搙偑懍偡偓傞偺偱丆忋柺偺8妱埵偼壗偐幷暳暔偱暍偭偰丆忲敪傪墴偝偊傞偲傛偄丏1乣2廡娫偟偰丆堦曈偑5乣6mm偺暯斅側惓曽宍偺寢徎偑悢懡偔摼傜傟傞偺偱丆傛偄宍偺傕偺偩偗庢傝弌偡丏師偵丆梕婍偵朞榓梟塼偺忋悷傒塼偩偗傪擖傟丆庢傝弌偟偨寢徎傪彮偟悈愻偟偰偐傜丆墶岦偒偵攚偑崅偔側傞傛偆偵梕婍偺掙偵暲傋傞丏梕婍偺忋傪8妱傎偳暍偄曻抲偡傞丏寢徎娫偵旝寢徎偑弌傟偽丆戝偒側寢徎偩偗庢傝弌偟丆朞榓梟塼偺忋悷傒塼偩偗偺忬懺偵偟偰丆嵞傃寢徎傪暲傋捈偡丏栺3乣8儠寧偱丆堦曈偑15乣22mm掱搙偺戝偒偝偺棫曽徎偑摼傜傟偨4)丏
丂乵寢徎偺惈幙乮傊偒奐乯摍乶
丂恾係偺傛偆偵丆摼傜傟偨戝偒側怘墫偺寢徎偺柺偵暯峴偵僫僀僼偺恘傪偁偰偑偄丆忋偐傜嬥捚偺傛偆側傕偺偱丆寉偔扏偄偰傒傞丏傢偢偐側椡偱怘墫偺寢徎偑恾俆偺傛偆偵妱傟傞丏妱傟偨柺偼傊偒奐柺偲偟偰抦傜傟偰偍傝丆偡傋偡傋偟偰偄傞丏偙偺柺偺廳側傞曽岦偵僀僆儞棻巕偺堷偭挘傝崌偆椡偑庛偔側偭偰偄傞丏恎嬤側寢徎偱偼丆昘嵒摐偱傕峴偆偙偲偑偱偒傞丏傊偒奐傪棙梡偟偰摼傜傟偨寢徎傪庬寢徎偵棙梡偟偰傕傛偄丏
恾係丏怘墫寢徎偺傊偒奐柺偱偺僇僢僩

丂乵怘墫寢徎拞偺悈暘乶
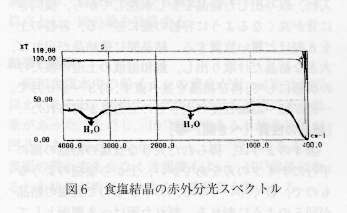
傊偒奐偱丆敄偔僗儔僀僗偟偨寢徎傪丆栚偺嵶偐偄僒儞僪傌亅僷亅偱杹偒丆嵟屻偵僼僃儖僩晍忋偱挌擩偵杹偔偲丆摟柧側怘墫偺斅僈儔僗偑摼傜傟傞丏怘墫偼愒奜慄偺偁傞攇挿斖埻偱偼媧廂偑側偔丆愒奜慄梡岝妛嵽椏偲偟偰傛偔棙梡偝傟偰偒偨乮僙儖丆僾儕僘儉摍乯丏崱夞摼傜傟偨怘墫偺斅僈儔僗傪愒奜暘岝岝搙寁偱挷傋傞偲丆傢偢偐偵悈偺媧廂偑偁傞乮恾俇偵愒奜暘岝僗儁僋僩儖傪帵偡乯丏梟塼偐傜寢徎壔拞偵庢傝崬傫偩傕偺偲峫偊傜傟傞偑丆嵀愓掱搙偱偁傞丏懳徠懁偲帋椏懁偵摨偠怘墫偺斅僈儔僗傪僙僢僥傿儞僌偡傞偲丆100亾偺儀亅僗儔僀儞偺埨掕惈偑曐偨傟偰偄傞偺偱丆偙偺怘墫斅僈儔僗傪巊偭偰丆愒奜暘岝岝搙寁偺帋椏僙儖偵棙梡偱偒傞丏
恾俇丏怘墫寢徎偺愒奜暘岝僗儁僋僩儖
丂乵怘墫寢徎傛傝枾搙丒傾儃僈僪儘悢乮俶乯偺應掕乶
乮侾乯枾搙乮俢乯傪媮傔傞
丂係偺曽朄偱惢憿偟偨怘墫傪傛偔杹偄偰丆棫曽懱偺宍傪惍偊傞丏廲丆墶丆崅偝偺奺曈偺挿偝傪僲僊僗偱嵍丆塃丆拞墰偲嶰夞應掕偟丆偦偺暯嬒抣傪媮傔傞丏偙傟傜偺暯嬒抣偺愊傛傝怘墫偺懱愊乮倁乯傪媮傔傞丏
師偵丆怘墫偺幙検乮俵乯傪應掕偟丆枾搙乮俢乯亖幙検乮俵乯乛懱愊乮倁乯傛傝寁嶼偡傞丏
椺丏幙検乮俵乯亖26.284g乮26.284乛58.44亖0.4498丂丂mol乯
丂丂懱愊乮倁乯亖2.357亊2.258亊2.200=12.241cm3
枾搙乮俢乯亖俵乛倁亖26.284乛12.241亖2.147g丂丂丒cm-3乮暥專抣丂枾搙亖2.17g丒cm-3乯
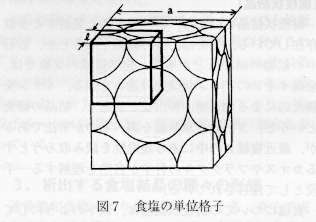
乮俀乯傾儃僈僪儘悢乮俶乯傪媮傔傞
丂恾俈偺傛偆偵丆堦曈倎偺怘墫宆寢徎偺扨埵奿巕拞偵偼丆Na+偑1乛4亊12亄1亖4屄丆Cl-偑1乛8亊8亄1/2亊6亖4屄偺棻巕偑娷傑傟偰偍傝丆崌寁8屄偺棻巕偑懚嵼偡傞丏偝傜偵怘墫偼恾7偵帵偟偨傛偆偵丆Na+偲Cl-偺堦曈偲偺扨弮棫曽奿巕宆偱偁傝丆偙偺拞偵偼Na+偑1乛2屄
,Cl-偑1乛2屄崌寁1屄偺棻巕偑懚嵼偡傞丏
丂師偵丆NaCl偺奿巕掕悢倎亖5.6406亊10-8cm傛傝丆堦曈丂偺扨弮棫曽奿巕宆偺懱愊偡側傢偪堦棻巕摉偨傝偺懱愊乮V0乯傪媮傔傞丏
丂扨弮棫曽奿巕宆偺堦曈偺挿偝偼丆丂亖倎乛2亖5.641亊10-8乛2=2.820亊10-8cm偲側傞丏廬偭偰丆堦棻巕摉偨傝偺懱愊乮V0乯亖乮2.820亊10-8乯3亖2.243亊
10-23cm3偲側傞丏
丂乮侾乯偺怘墫寢徎偺幚應懱愊乮倁乯傪堦棻巕摉偨傝偺懱愊乮V0乯偱彍偡傞丏
倁乛V0亖12.241乛2.243亊10-23亖5.465亊1023屄亅嘆乮偙傟偼怘墫寢徎拞偺奿巕悢傪帵偟偰偍傝丆傑偨丆
Na+偲Cl-偺崌寁偺棻巕悢偱偁傞乯丏
偦偟偰丆NaCl偺侾mol拞偵偼丆
俀亊傾儃僈僪儘悢乮俶乯屄亅嘇
偺棻巕偑娷傑傟傞偺偱丆0.4498mol拞偵偼丆
0.4498亊俀亊俶屄偺棻巕悢偵側傞丏嘆偍傛傃嘇傛傝5.465亊1023亖0.4498亊2亊俶丆廬偭偰傾儃僈僪儘悢乮俶乯亖6.075亊1023偲側傞丏
恾俈丏怘墫偺扨埵奿巕
俆丏偍傢傝偵
戝偒偔偰摟柧側怘墫偺寢徎嶌傝傊偺挧愴偲偟偰丆廬棃傛傝pH傗Pb2+丆Mn2+偺攠徎岠壥偑抦傜傟偰偄偨丏偙偙偱偼丆Pb2+偵偮偄偰堦斣揔惓側壔妛揑忦審傪扵傞偲偲傕偵丆偱偒偁偑偭偨寢徎偵偮偄偰傕偝傜偵敪揥偟偨慺嵽偲偟偰偺妶梡傪峫偊偨丏偙偺傛偆偵丆堦偮偺嫵嵽傪敪揥揑偵揥奐偡傞偙偲偼丆帺慠壢妛慡斒偵懳偡傞嫽枴丒娭怱傪偝傜偵姭婲偡傞偺偱偼側偄偩傠偆偐丏
嶲峫暥專
1) 擔杮奀悈妛夛曇丗奀墫偺壔妛乮擔杮奀悈妛夛丆丂1976乯p.186丏
2) 寢徎岺妛僴儞僪僽僢僋曇廤埾堳夛曇丗寢徎岺妛僴 丂儞僪僽僢僋乮嫟棫弌斉丆1971乯p.879丏
3) 攏楬塸榓丒棙埨媊梇丗戝嶃偲壢妛嫵堢丆3 (1989) 丂p.1乣6丏
4) 戝嶃晎壢妛嫵堢僙儞僞亅曇丗棟壢幚尡僈僀僪僽僢 丂僋 (1993) p.42丏